8月2日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室吴姗教授团队与浙江大学医学院郭江涛教授团队、杨帆教授团队合作,在国际重要学术期刊Nature在线发表题为“Structures and mechanisms of the Arabidopsis auxin transporter PIN3”(拟南芥生长素转运蛋白PIN3的结构和机制)的研究论文。该研究报道了拟南芥PIN3(AtPIN3)在apo状态、生长素吲哚乙酸IAA结合状态和NPA结合状态下的3个高分辨率冷冻电镜结构,为理解PIN介导生长素转运和NPA抑制生长素极性运输的分子机制提供了结构基础,进而为靶向该转运体的创新农药研发打下基础。这是湖北大学首次以通讯单位在Nature发表研究论文。
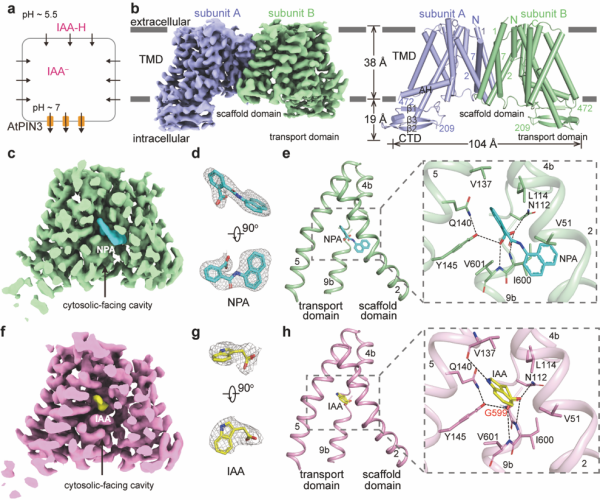
图1. AtPIN3的结构。a.3H-IAA转运体系模式图。b. AtPIN3的密度图和结构图。c. AtPIN3NPA的密度图。d. NPA的密度图。e. AtPIN3NPA结构中NPA的结合位点。f. AtPIN3IAA的密度图。g. IAA的密度图。h. AtPIN3IAA结构中IAA的结合位点。
生长素是最重要的一类植物激素,对植物生长发育起核心调控作用。在种子植物中,生长素主要通过极性运输或者维管系统进行运输。PIN家族蛋白介导生长素外排,是承担植物体生长素极性运输的最重要的转运蛋白。PIN突变体会影响PIN极性定位和活性,从而导致生长素分布失衡。NPA(N-1-naphthylphthalamic acid)是一种除草剂,也是生长素极性运输的抑制剂。长期以来,人们对PIN如何介导生长素的外排,以及NPA如何抑制生长素的极性运输的分子机制尚不清楚。研究人员通过单颗粒冷冻电镜技术,解析了AtPIN3在apo状态、NPA结合状态以及IAA结合状态下的高分辨率结构。三个结构类似,且均为向内开放状态(图1b,c, f)。AtPIN3NPA和AtPIN3IAA复合物结构清楚地揭示了NPA、IAA与AtPIN3的结合模式。NPA与IAA的结合模式类似(图1d, e, g, h),抑制剂NPA和底物IAA的结合位点重叠,揭示了NPA抑制生长素极性运输的分子机制:NPA作为竞争性抑制剂,直接占据生长素在PIN上的结合位点,并抑制了转运过程中PIN的潜在构象变化。
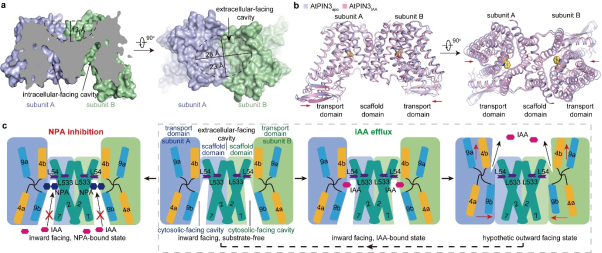
图2. AtPIN3转运生长素分子机制。 a.AtPIN3二聚化界面展示。b.AtPIN3apo和AtPIN3IAA结构比较。c. AtPIN3转运生长素IAA和NPA抑制AtPIN3活性的分子机制模型。
随后,为了进一步验证IAA和NPA在AtPIN3中的结合模式,研究人员对AtPIN3上与IAA和NPA有相互作用的残基进行了点突变,并在体外放射性3H-IAA转运实验体系中检验其功能。 此外,研究人员将野生型AtPIN3和突变体进行表达纯化,通过表面等离子体共振技术(SPR),测定了AtPIN3分别与IAA和NPA的解离常数(KD)。两者实验结果进一步验证了冷冻电镜结构中观察到的IAA和NPA与AtPIN3的结合模式。本文系统性地解析了AtPIN3在apo状态、底物(IAA)结合状态以及抑制剂(NPA)结合状态下的高分率结构,揭示了AtPIN3的结构、IAA识别机制及NPA抑制的分子机制,将有力促进对PIN介导的生长素运输分子机制的理解(图2)。

图3.湖北大学研究团队主要成员合影。左起:陶鑫、马立新、吴姗
据悉,湖北大学与浙江大学为本文共同通讯单位,郭江涛教授、吴姗教授和杨帆教授为共同通讯作者,浙江大学医学院博士后苏楠楠、博士生竺爱琴和湖北大学生命科学学院博士生陶鑫为共同第一作者,参与这项工作的还有湖北大学生命科学学院马立新教授等。
吴姗教授2019年初加入湖北大学,负责搭建湖北大学冷冻电镜平台。本文为湖北大学冷冻电镜平台2021年7月正式运行以来第一篇在线发表的高水平文章。吴姗教授团队长期从事生物大分子的精细结构解析与相关分子机制研究,在Nature、Science、Nature Structural & Molecular Biology、Nature Communications等国际知名期刊上发表多篇高水平文章。本研究工作受国家自然科学基金委、国家重点研发计划等资助。
论文链接:https://www.nature.com/articles/s41586-022-05142-w
(审稿:谢玉平)